<NBS5123> SYTOX Green Nucleic Acid Stain (5 mM in DMSO) 死細胞綠色熒光核酸染料
貨號:NBS5123-50ul
NBS5123-50ul
SYTOX Green Nucleic Acid Stain (5 mM in DMSO)
死細胞綠色熒光核酸染料
產品編號 | 產品名稱 | 包裝規格 | 價格 |
NBS5123-50ul | SYTOX Green Nucleic Acid Stain (5 mM in DMSO) | 50ul | 1600 |
產品簡介:
SYTOX Green核酸染料(SYTOX Green Nucleic Acid Stain),是一種高親和力的核酸染料,輕易滲透進入受損的細胞質膜,但不能穿透活細胞膜。特別適用于革蘭氏陽性菌(G+)和革蘭氏陰性菌(G-),由于它們需要極其明亮的熒光信號。探針只需簡單孵育,使用氬離子激光器的488nm激光或任何其它450-490nm光源激發,死細胞的核酸則呈明亮的綠色熒光。結合以上特征,以及熒光增強>500倍(與核酸結合)的優點,使其稱為一種簡單、定量的一步法死細胞指示劑,當用熒光顯微鏡、熒光光度計、熒光酶標板和流式細胞儀檢測。
SYTOX Green核酸染料可與藍色和紅色熒光的表面標記聯合使用,用于多指標分析。也能將SYTOX Green與任一種具細胞滲透性的SYTO 59-64紅色熒光核酸染料聯合雙色標記死細胞和活細胞。SYTOX Green是一種優秀的DNA復染劑,用于染色體標記以及固定細胞和組織的染色。
本品以DMSO儲存液形式提供,濃度為5mM。只需用合適的生理緩沖液稀釋到工作濃度進行簡單孵育即可。適用于哺乳動物細胞、革蘭氏陽性和革蘭氏陰性菌。
產品特性
1) 同義名:SYTOX Greendye;SYTOX Green死細胞染料;死細胞染料綠菁;SYTOX Green細胞核染料;
2) 外觀:橙色至紅色溶液
3) 熒光特征:EX/Em=504/523nm(與DNA結合)
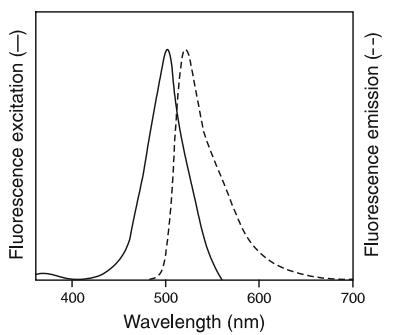
圖1.SYTOX Green與DNA結合的熒光激發和發射光譜。于10mM Tris-HCl,1mM EDTA, pH 7.5的反應體系內,將1個染料分子與50個DNA堿基對結合之后檢測所得的光譜。
保存條件:
20℃避光干燥保存,至少1年有效。
產品使用:(以下步驟僅用作示例以指導科研人員開展自身細菌樣本的染色)
基于實驗室經驗和發表方法,建議使用廣譜的染色濃度來開展使用,并且根據自身的細胞類型和實驗體系來優化摸索出最佳的工作濃度(見表1)。
使用塑料管來稀釋SYTOX染料,由于稀釋后的染料會粘附到玻璃上。總的來說,用不含磷酸鹽的緩沖液來染色能得到最好的結果。塑料或玻璃器皿上殘留的去污劑也有可能影響許多細胞或有機體的真實染色,導致在含或不含細胞的溶液中都能看到發明亮熒光的材料。確保用溫和去污劑來清洗玻璃器皿,用熱自來水完全沖洗干凈,最后用去離子水清洗數次。
表1. SYTOX染色不同細胞的建議工作濃度 | ||
細胞類型 | SYTOX Green濃度 | 孵育條件 |
細菌 | 0.5-5.0 μM | 渦旋混勻,之后孵育5min以上 |
酵母 | 1.0-50 μM | 孵育10min以上,周期性搖晃管子 |
其它真核細胞 | 10 nM-1 μM | 孵育10min以上 |
①離心收集細胞,用生理鹽溶液或水重懸細胞。貼壁細胞(比如:哺乳動物細胞)可能在蓋玻個染料濃度,片上原位染色。使用表12內建議的工作濃度進行染色。初次實驗,建議在建議濃度范圍內做多,以確定能得到最佳染色的工作濃度。需要注意:生長培養基、細胞密度、是否存在其它細胞、和其它因素都可能影響染色。
②染色的真核細胞通常顯示出彌散的細胞漿染色和細胞核染色,特別是經常看到明亮的核內小體染色。由于此染料具細胞膜滲透性,且中性pH下帶凈正電荷,也有可能染線粒體。活酵母菌內主要是線粒體染色。
注意事項:
1. 熒光染料均存在淬滅問題,請盡量注意避光,以減緩熒光淬滅。
2. 為了您的安全和健康,請穿實驗服并戴一次性手套操作。
應用示例:
文獻1:
實驗目的:利用二種熒光染料(CFW+ SYTOX green)雙重標記來定量檢測孢子囊內的游動孢子含量。
實驗方法:首先,用經典的核酸染料DAPI(1 μg/ml?1)和特異性染色質熒光素增白劑(calcofluor white , CFW, 2.5%v/v)。之后,結合核酸染料SYTOX green和CFW染色。SYTOX green的不同濃度(0.1 μM, 0.2 μM, 和0.5 μM)和孵育時間(30 min,1 h)進行優化。CFW工作濃度為2.5% (vol/vol) 。CFW要么與SYTOX green同時加入樣本,或觀察前5min再加入樣本。染色步驟和結果總結見圖1。最佳的染色條件是:先用0.1 μM SYTOX green孵育55min,再加入CFW共同孵育5min。
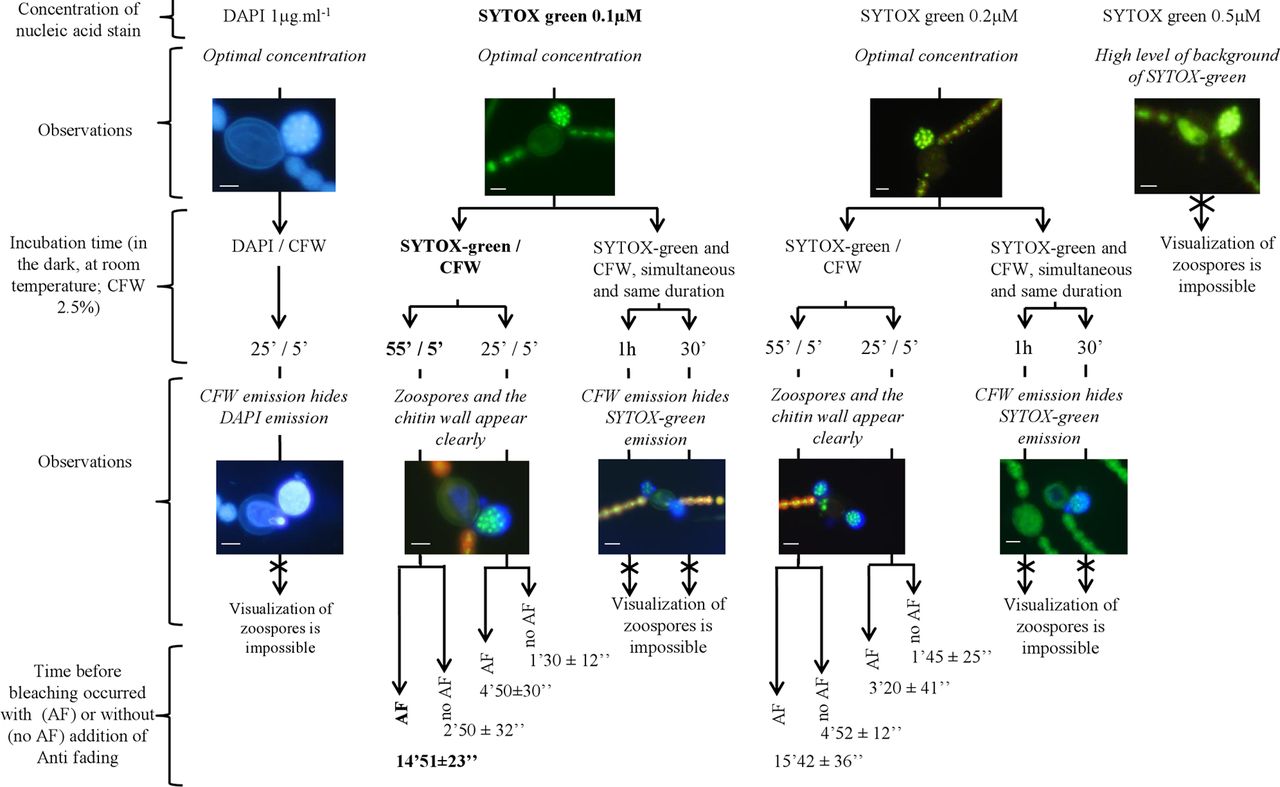
Fig 1. Different concentration and incubation time procedures tested for double staining method and epifluorescence microscopy observation of zoosporic content and sporangia of phytoplankton parasitic chytrid. Optimal procedures are indicated with bold characters. Bars, 10 μm.
文獻2:
實驗目的:使用SYTOX Green和DAPI來評估細菌活力。
實驗方法:用DAPI (10 μg/ml in Morse's Defined Medium)室溫避光標記細菌20min;用標記好的細菌感染24孔板內貼壁培養的細胞,不要用醛或有機溶劑來固定細胞;用MOPS/MgCl2清洗一次;用Alexa Fluor 647結合的抗體或凝集素標記感興趣的細菌,室溫避光操作10min,來檢測外部細菌;吸走細胞培養基,加入SYTOX Green(0.4 μMin MOPS/MgCl2)。室溫避光孵育5min。MOPS/MgCl2清洗2次;MOPS/MgCl2再清洗1次;于30min內用熒光顯微鏡收集圖片。
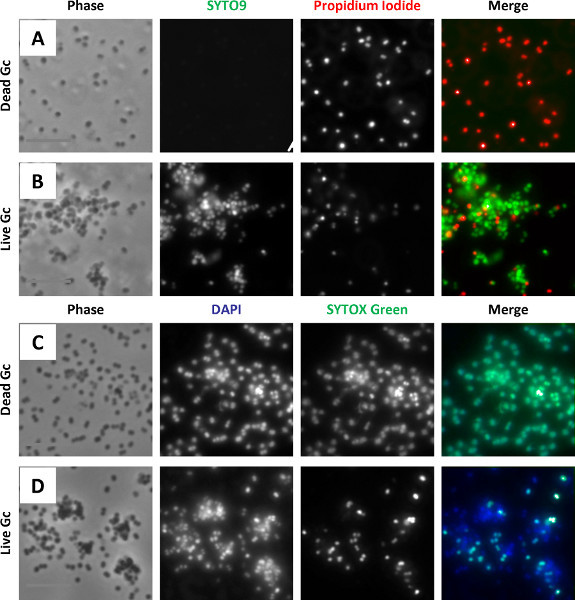
Fig 2. (A-B) Mid-logarithmic phase N. gonorrhoeae was exposed to propidium iodide and SYTO9 as in protocol 1, with (A) or without (B) isopropanol treatment to kill the bacteria. Nonviable bacteria are accessible to propidium iodide and appear red. Viable bacteria are stained with SYTO9 and appear green. (C-D) Mid-logarithmic phase N. gonorrhoeae was exposed to DAPI and SYTOX Green as in protocol 2, with (C) or without (D) isopropanol treatment to kill the bacteria. Nonviable bacteria are accessible to DAPI and SYTOX Green and appear blue + green. Viable bacteria are stained with DAPI only and appear blue only.
相關產品:
產品編號 | 產品名稱 | 包裝規格 |
5mg | ||
1mg | ||
10mg | ||
10mg | ||
50ul | ||
50ul | ||
20ul | ||
40T |



