NoninBio?基質膠使用指南.pdf
NoninBio?標準型基質膠,含酚紅;
NoninBio?低生長因子基質膠 ,無酚紅;
NoninBio?低生長因子基質膠 ,含酚紅;
NoninBio?高濃度基質膠,無酚紅;
NoninBio?高濃度基質膠,含酚紅;
NoninBio?類器官專用基質膠 ,無酚紅;
NoninBio?干細胞專用基質膠 ,無酚紅;
品牌:NoninBio
NoninBio?基質膠使用指南
Part I 基質膠——常識篇
1 、基質膠分類?
基質膠主要分為 5 大類(表 1),分別為標準型(Standard, STD)、細胞因子減少型(Growth Factor Reduced, GFR) 、高濃度型(High Concentration, HC) 、類器官專用型(Organoid)和干細胞專用 型(Embryonic Stem Cell, ESC)。
2 、應該采購哪一款的基質膠?
2. 1 標準型基質膠適用于適用于極化細胞的培養,如上皮細胞。促進多種類型細胞的分化, 包括肝細胞、神經元、β-胰島細胞、乳腺上皮細胞、內皮細胞和平滑肌細胞。例如侵襲實驗、 成管實驗等。
2.2 細胞因子減少型基質膠適用要求基質膠成分相對明確的實驗,例如類器官培養、血管生 成、干細胞培養等。
2.3 高濃度型基質膠適用于體內成瘤(CDX 、PDX)和體內血管生成(Plug Assay)等。高濃度基 質膠成膠速度快,凝膠剛性高,具有更好的支架效果(Cell Scaffold)。
2.4 類器官專用型基質膠屬于細胞因子減少型亞類,有較高濃度和剛性,且通過小鼠小腸類 器官培養測試,能再現小腸類器官出芽表型和分子標志物表達特征。
2.5 胚胎干細胞專用型基質膠是經驗證具有特定培養基兼容性,且穩定維持干細胞形狀和干 性的基質膠。
表 1 基質膠分類和應用場景
標準型 Standard | 生長因子減少 | 高濃度 HC | 類 器 官 專 用 Organoid | 干 細 胞 專 用 Stem cell | |
應 用 場 景 | 適用于極化細胞的培養, | 適用需要成分相明確的基底 | 高濃度基質膠凝膠 后具有更高的剛度 和支架完整性。適 合體內細胞運輸應 用,可改善細胞植 入效果并促進實體 瘤形成。 | 精選適合類器官培 養基質膠(濃度、剛度)。 | 經驗證具有特定培養 |
來 源 | 小鼠肉瘤 | ||||
蛋白濃度 | 8-12 mg/ml | 8-12 mg/ml | 16-22 mg/ml | 8-12 mg/ml | 8-12 mg/ml |
保 質 期 | 從生產時期計時,2年 | ||||
貨 號 | NBJ6234-5ml(含酚紅) NBJ6234-10ml(含酚紅) NBJ6237-5ml(無酚紅) NBJ6237-10ml(無酚紅) | NBJ6230-5ml(含酚紅) NBJ6230-10ml(含酚紅) NBJ6231-5ml(無酚紅) NBJ6231-10ml(無酚紅) | NBJ4248-5ml(含酚紅) NBJ4248-10ml(含酚紅) NBJ4262-5ml(無酚紅) NBJ4262-10ml(無酚紅) | NBJ6255-5ml(無酚紅) NBJ6255-10ml(無酚紅) | NBJ4277-5ml(無酚紅) NBJ4277-10ml(無酚紅) |
NoninBio?基質膠產品列表
| 大類 | 亞類 | 貨號 | 規格 | 目錄價 | 對標康寧貨號 |
| NoninBio?標準型基質膠 | 無酚紅 | NBJ6237 | 5 ml | 1530 | 康寧不含酚紅的標準型基質膠沒有5ml規格 |
| 10 ml | 2720 | 356237 | |||
| 含酚紅 | NBJ6234 | 5 ml | 1530 | 356234 | |
| 10 ml | 2720 | 354234 | |||
| NoninBio?低生長因子基質膠 | 無酚紅 | NBJ6231 | 5 ml | 1870 | 康寧不含酚紅的低生長因子基質膠沒有5ml規格 |
| 10 ml | 3485 | 356231 | |||
| 含酚紅 | NBJ6230 | 5 ml | 1870 | 356230 | |
| 10 ml | 3485 | 354230 | |||
| NoninBio?高濃度基質膠 | 無酚紅 | NBJ4262 | 5 ml | 2720 | 康寧不含酚紅的高濃度基質膠沒有5ml規格 |
| 10 ml | 5270 | 354262 | |||
| 含酚紅 | NBJ4248 | 5 ml | 2720 | 康寧含酚紅的高濃度基質膠沒有5ml規格 | |
| 10 ml | 5270 | 354248 | |||
| NoninBio?類器官專用基質膠 | 無酚紅 | NBJ6255 | 5 ml | 2125 | 康寧類器官專用基質膠沒有5ml規格 |
| 10 ml | 3910 | 356255 | |||
| NoninBio?干細胞專用基質膠 | 無酚紅 | NBJ4277 | 5 ml | 1955 | 354277 |
| 10 ml | 3570 | 康寧干細胞專用基質膠沒有10ml規格,因為酚紅有點雌激素,所以我們的干細胞專用基質膠沒有加酚紅 |
3 、基質膠保存、解凍、運輸和分裝?
保存:基質膠通常保存于-20 ℃的無除霜功能冰箱;
解凍:將基質膠包裝瓶埋于碎冰中(僅暴露瓶口),置于 2-8℃冰箱過夜;
運輸:干冰物流運輸;
分裝:結合每輪實驗基質膠使用量進行分裝,分裝后于-20 ℃的無除霜功能冰箱保存,避免 反復凍融。
4 、使用基質膠前需要試劑和耗材預冷嗎?
由于基質膠在高于 8 ℃的環境溫度下就會以不可逆形式聚合形成凝膠,所以在操作基質膠過 程中,試劑(培養液、稀釋液、細胞懸液等)和耗材(吸頭、培養皿、EP 管和管架等)都 要求預冷,冰上操作。
5 、基質膠顏色和狀態?
凍存狀態下,含酚紅基質膠顏色通常為淺橘紅色,不含酚紅基質膠呈現碎冰樣白色;解凍后, 含酚紅基質膠紫紅色。解凍后不含酚紅高濃度基質膠為半透明濃稠濁液,低濃度基質膠為近 乎透明狀液體。
6、基質膠出現沉淀怎么辦?
如發現基質膠存在少量沉淀,建議 4 ℃低速離心后使用(5000 rpm for 5 min),通常不影響基 質膠活性。
7、包被培養皿時,基質膠使用量?
表 2 基質膠包被培養皿用量指導
薄膠 Thin Gel | 厚膠 Thick Gel |
50 ul/cm2 | 150-200 ul/cm2 |
培養皿 Culture ware | 生長面積 Growth area(cm2) |
6-well plate | 9.6 |
24-well plate | 2.0 |
96-well plate | 0.32 |
35 mm x 10 mm dish | 11.78 |
100 mm x 20 mm dish | 58.95 |
Part II 基質膠——實操篇
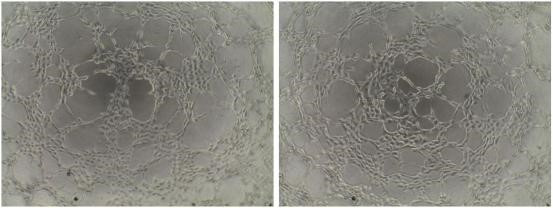
1 、內皮細胞血管生成實驗(Tube Formation Assay)
1.1 實驗目的
血管形成實驗是體外研究血管生成的經典方法,該方法可快速確定調控血管生成的基因、 小分子或信號通路,結合鈣黃綠素(Calcein)染色和 Image J 分析工具,可以實現血管生成的 定量分析。
1.2 實驗步驟
1.2. 1 包被:基質膠解凍后,按照每孔 50-60 μl 的量加入預冷 96 孔板培養孔中(盡量避 免基質膠產生氣泡) ,并輕輕搖晃培養板,使基質膠均勻鋪于培養孔孔底;然后置于 37 ℃細 胞培養箱聚合 30 min。
1.2.2 細胞制備:將對數生長期培養中的 HUVEC 細胞消化,制備成 2E+5 cell/ml 懸液(計 數一定要準確)。
1.2.3 接種:細胞混勻計數后,將細胞接種至已報備培養孔中,每孔 100 μl ,輕輕搖勻 后,置于 37 ℃細胞培養箱繼續培養。
1.2.4 觀察:培養 6 h(或其他指定時間點)后,顯微鏡下觀察成管情況,同時采集照片。
1.3 注意事項
1.4.1 血管內皮細胞成管實驗推薦使用標準型(貨號: NBJ6234)或細胞因子減少型(貨 號:NBJ6230)基質膠,膠濃度為 8-10 mg/ml 最佳。
1.4.2 體外血管形成實驗除了選好合適的基質膠之外, 內皮細胞的狀態也極為關鍵,建 議選擇 3-5 代次的細胞進行實驗,鋪板接種前注意細胞狀態(對數生長期)并進行饑餓培養。 同時細胞接種數量不能過稀或者過密。
1.4 結果示例
2 、侵襲實驗(Invasion)
2.1 實驗目的
細胞侵襲實驗是體外模擬細胞主動突破物理屏障發生位置轉移能力的一種實驗技術,被 廣泛應用于各種細胞侵襲轉移能力探索研究中,結合結晶紫染色可實現定量分析。應用于炎 癥反應、癌癥轉移、胚胎發育、血管生成、傷口愈合、免疫反應、動脈粥樣硬化等研究領域。
2.2 實驗步驟
2.2. 1 基質膠稀釋:基質膠解凍后,將基質膠用無血清培養基稀釋至 1 mg/ml 左右,混勻后 冰置于上備用。
2.2.2 小室鋪膠:按照每小室 60 μl 的量將稀釋后的基質膠垂直加入預冷小室底部,不要產生 氣泡,然后置于 37℃細胞培養箱孵育 2-3 h ,使基質膠充分聚合為薄膜層。
2.2.3 基底膜水化:孵育后將小室中多余液體小心吸掉,加入 100 ul 無血清培養基,然后置 于 37℃細胞培養箱孵育 30 min ,使基底膜充分水化。
2.2.4 檢漏:小心吸出小室中液體,檢查是否有液體穿過小室進入下室中,若漏液則可用于 下游細胞接種(選做,非必須)。
2.2.5 細胞制備:消化對數生長期待檢測細胞,清洗后細胞重懸計數,將細胞濃度調整至 1-10e+5 cell/ml(根據待測細胞的遷移能力強弱調整細胞密度);在 24 孔板下室加入 600 μl 含 5%-10% FBS 或趨化因子的培養基,然后用鑷子將 Transwell 小室置于 24 孔板內,取適量 細胞懸液(100-200 μL)加入上室,最后置于培養箱中培養 12-48 h(細胞量和時間視細胞侵襲 能力變化,結合預實驗確定);同時設置對照孔,下室添加等體積無血清培養基。
2.2.6 固定:在指定時間點,取出 Transwell 小室,去除培養液,用 PBS 浸濕的棉簽或棉花輕 輕擦拭小室內基質膠和細胞。在 24 孔板干凈的孔中加入 600 μl 4%多聚甲醛固定液,將小室 放入固定 30 分鐘。然后棄固定液,PBS 洗滌小室內外 1 次。
2.2.7 結晶紫染色:在 24 孔板干凈的孔中加入 600 uL 結晶紫染色液,將小室放入染色 10 分 鐘。
2.2.8 取出小室,PBS 洗滌小室內外 3 次。適當風干后,顯微鏡下觀察定性研究;取 3-5 個 視野拍照。
2.2.9 定量分析:用 Image J 計數取平均值進行定量研究。
2.3 注意事項
2.3. 1 根據細胞大小選擇合適的 Transwell chamber 小室,常用的為 8 μm 孔徑,細胞培養板 有 6- ,12-和 24-孔板等,最常用的是 24 孔板。
2.3.2 接種細胞狀態和密度非常關鍵,需結合預實驗確定接種數量以及后續檢測固定染色時 間點。
2.4 結果示例

3 、皮下成瘤(Xenograft)
3.1 實驗目的
皮下成瘤實驗為腫瘤發生發展研究和腫瘤藥物開發奠定了疾病模型基礎,被廣發應用于各種 腫瘤發病機制研究。高濃度基質膠有效促進腫瘤形成,為腫瘤細胞提供合適的生長微環境。
3.2 實驗步驟
3.2. 1 選取對數生長期的細胞,細胞匯合度達 80-90%左右為宜;
3.2.2 消化細胞后用預冷的 PBS 洗兩遍, 目的為去除細胞中殘余的血清和胰酶。
3.2.3 細胞用預冷 PBS 或無血清培養重懸,計數并根據需求調整細胞密度。細胞懸液與高濃 度基質膠 1:1 混勻(如果細胞成瘤能力較高,基質膠終濃度可以降低)。一般皮下瘤接種的 細胞量為 1-5×10^6 個細胞/鼠,接種體積為 0.1-0.2 ml。
3.2.4 裸鼠周齡 4-6 周齡,體重 16-18 g 左右,種植部位選擇血供豐富區域,如腋下中后部;
3.2.5 從進針部位向前穿刺大約 1 cm ,進行皮下注射,針頭在皮下左右滑動幾次,以便細胞 接種成團,避免注射后細胞懸液從針眼溢出;
3.2.6 接種后正常飼養,4-6 周成瘤,過程中檢測小鼠體重,腫瘤體積變化;最后取瘤進行 拍照成像,保存組織用于下游實驗檢測。
3.3 注意事項
3.3. 1 細胞與基質膠混勻后,需置于冰上放置,并盡快注射,避免基質膠聚合;同時低溫能 降低細胞代謝,維持細胞活力。
3.3.2 不同細胞成瘤能力也不同,所以細胞接種數量需結合預實驗確定最佳值。
3.3.3 稀釋后的基質膠濃度不可低于 4 mg/ml。
3.4 結果示例
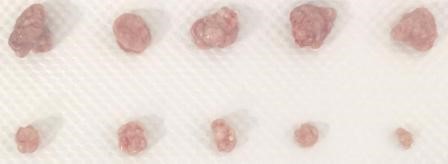
注:上排為加基質膠組,下排為 PBS 對照組
4 基質膠塞實驗(Matrigel Plug Assay)
4.1 實驗目的
基質膠塞實驗是體內探究血管生成的一種技術,可用于分析調控血管生成的基因、小分 子或者信號通路,結合病理染色實驗能實現血管生成的定性和定量檢測。
4.2 實驗步驟
4.2. 1 從-20℃或-80℃冰箱取出高濃度基質膠,將其埋于碎冰之中,置于 4 ℃冰箱過夜 解凍。
4.2.2 將 EP 管、注射器、針頭、吸管等置于 4℃或冰上預冷,避免后續基質膠操作過程 中提前聚合凝膠。
4.2.3 將 500 ul 高濃度基質膠轉移至 1.5 ml EP 管中,并添加待測藥品(小分子化合物和 蛋白等),充分混勻后置于冰上。
4.2.4 麻醉小鼠(注射阿佛丁或其他吸入式麻醉)。麻醉后剃毛刀剃出小鼠身體一側待 注射位置毛發,酒精棉擦拭消毒備用。
4.2.5 在備皮處進行皮下注射,注射時速度切記不要太快,慢慢推進給藥;注射后 7-15d 形成基質膠塞,并血管化。
4.2.6 血管生成實驗結束后,麻醉處死小鼠,取出基質膠塞,置于 DMEM 中,去除基 質膠塞表面粘附的其他組織,然后于 PBS 中再次清洗。
4.2.7 圖像采集與樣本保存:清洗干凈后拍照保存,膠塞的紅色程度代表血管生成的水 平;樣本保存后,可以用于病理染色分析血管形成的組織形態。
4.3 結果示例

Akhtar N, Dickerson EB, Auerbach R. The sponge/Matrigel angiogenesis assay[J]. Angiogenesis, 2002, 5: 75-80.
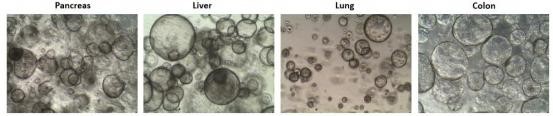
5 、類器官培養(Organoids)
5.1 實驗目的
利用臨床來源生物標本的祖細胞或者干細胞株(例如 iPS ,ADSC 等), 以基質膠作為 三維立體培養支架(Scaffold),在特定細胞因子作用下,體外誘導生成的類組織微球并定義為 類器官(Organoids)。其細胞分序組織結構、遺傳物質穩定性以及藥物反應性與供體基本一致, 在新藥研發、精準醫學、再生醫學、基礎科研等領域具有重要的應用價值和前景。
5.2 實驗步驟
5.2. 1 解凍:從-20℃或-80℃冰箱取出基質膠,將其埋于碎冰之中(瓶扣朝上),并將冰盒置 于 4 ℃冰箱過夜解凍。
5.2.2 分裝:解凍后,輕輕搖勻基質膠,并結合每次實驗基質膠需求量,分裝基質膠,保留
1 管即用,其他的分裝后立即轉移至-20 ℃無除霜功能冰箱凍存(注:盡量放置到冰箱最深 處,避免冰箱門附近放置)。
5.2.3 細胞制備:組織樣本消化、制備單細胞懸液以及計數(略)。
5.2.4 穹頂制備:將細胞沉淀(冰上預冷)用基質膠重懸并混勻(膠:細胞懸液比值大于等 于 1.5),進行點膠(Dome),點膠完成后,將培養板倒扣轉移至培養箱,37 ℃孵育 15-30 min; 然后添加適量已預熱的完全培養基(緩慢輕柔),置于 37 ℃ , 5% CO2 培養箱中孵育培養, 每天觀察類器官生長情況,結合類器官數量等安排換液(換液時培養基提前預熱)、傳代或 者凍存。
5.3 結果示例
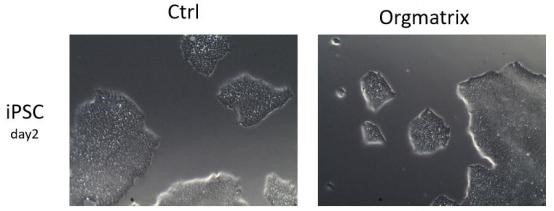
6 、干細胞培養(Stem cell)
6.1 實驗目的
干細胞(Stem cell)是一類具有自我更新和分化潛能的細胞,例如 iPSC ,ESC 等。通 常干細胞培養時需要血清和/或胚胎成纖維細胞飼養層的加持,但是該方法后續篩選工作耗 時,且實驗再現性和一致性相對較差。基質膠作為干細胞培養包被基質,一定程度上降低了 干細胞培養的繁瑣性,同時實驗結果具有更好的再現性和一致性。
6.2 實驗步驟(以 iPSC 為例)
6.2. 1 解凍:從-20 ℃或-80℃冰箱取出基質膠,將其埋于碎冰之中(瓶扣朝上),并將冰盒置 于 4 ℃冰箱過夜解凍。
6.2.2 分裝:解凍后,輕輕搖勻基質膠,并結合每次實驗基質膠需求量,分裝基質膠,保留
1 管即用,其他的分裝后立即轉移至-20 ℃無除霜功能冰箱凍存(注:盡量放置到冰箱最深 處,避免冰箱門附近放置)。
6.2.3 稀釋:將基質膠按照預定比例用預冷 DMEM/F12 稀釋(具體稀釋比例需結合基質膠濃 度和預實驗確定,通常稀釋倍數在 50-100 之間)。
6.2.4 包被:將稀釋后的基質加入 6 孔培養板(1 mL/孔)或 100 mm 培養皿(8 mL/培養皿) 。在 使用前請將培養皿在室溫下(37 ℃)孵育 2 小時,待基質膠聚合后,使用前小心吸出培養皿中 剩余的液體,盡量避免刮擦培養表面。
6.2.5 接種:將制備好的 iPSC 細胞懸液接種到包被后的培養板或培養皿中,輕輕搖勻細胞, 于 37 ℃ , 5% CO2 培養箱中孵育培養,每天觀察細胞狀態并每天更換培養基。
6.3 結果示例